Loja de Aquariofilia e de Aquascaping
Bem vindo ao nosso Blog!
O blog da Soluções Aquáticas é um espaço dedicado à partilha de conhecimento sobre aquariofilia e aquascaping. Aqui encontras artigos aprofundados, explicações acessíveis e conteúdo técnico sobre parâmetros da água, comportamento de espécies, plantas aquáticas, fertilização, CO₂, KH, pH, montagem de aquários e muito mais.
Cada texto é baseado na experiência prática da nossa loja e escrito com atenção ao detalhe, garantindo informação clara, útil e fiável. Se procuras compreender melhor o teu aquário e tomar decisões conscientes, este é o lugar certo.
Todos os textos são originais, com conteúdo educativo e atual. Soluções Aquáticas – informação que faz crescer o teu aquário.
Ao longo da série, falámos sobre macronutrientes como nitrato, fosfato, potássio, e sobre os micronutrientes mais comuns como ferro e manganês. Mas há dois elementos que não se encaixam tão facilmente numa categoria ou noutra: cálcio (Ca) e magnésio (Mg).
Ambos são fundamentais para o metabolismo das plantas, mas estão muitas vezes escondidos sob o valor de GH (dureza geral), o que complica um pouco a sua leitura e gestão.
O GH (General Hardness) mede a concentração total de sais de cálcio e magnésio dissolvidos na água. O problema é que não nos diz o rácio entre os dois, o que é crucial.
Por exemplo: podes ter um GH de 4 dGH com 90% de cálcio e 10% de magnésio, ou exatamente o oposto. Em ambos os casos, o teste dá o mesmo valor, mas as plantas podem estar em carência de um ou de outro.
O cálcio atua principalmente:
No desenvolvimento das paredes celulares,
Na transmissão de sinais entre células,
E como estabilizador estrutural das plantas.
É relativamente fácil encontrá-lo na água da torneira, especialmente em Portugal. A não ser que uses água 100% de osmose reversa, é raro precisares de suplementar cálcio.
O magnésio, por outro lado, é muitas vezes negligenciado, mas é absolutamente vital. Ele:
É o átomo central da clorofila (sem ele, não há fotossíntese),
Atua na formação e transporte de ATP (energia celular),
Participa na ativação de enzimas e regulação osmótica.
Uma planta com carência de magnésio produz menos clorofila e tem menor capacidade de aproveitar a luz.
Folhas com amarelecimento entre os veios (interveinal),
Sintomas visíveis nas folhas mais velhas (nutriente móvel),
Em casos graves, crescimento atrofiado.
Muitas águas da rede pública em Portugal já contêm bastante cálcio. No entanto, o magnésio nem sempre está presente em quantidade suficiente.
Um GH alto não significa equilíbrio entre Ca e Mg.
Por exemplo, no Barreiro, os níveis de cálcio são elevados, mas o magnésio é bastante reduzido — o que pode levar a carências disfarçadas, especialmente em aquários exigentes.
Idealmente, o rácio entre cálcio e magnésio deve ser algo próximo de 4:1 (Ca:Mg). Para setups mais exigentes, ou se usas água de osmose, podes:
Usar remineralizadores com proporções equilibradas (GH Boosters),
Suplementar magnésio isoladamente com sulfato de magnésio (MgSO₄).
Valores de referência semanais (via fertilização ou água de base):
Cálcio (Ca): 10 a 40 ppm
Magnésio (Mg): 2 a 10 ppm
O GH sozinho não revela tudo — é necessário entender a proporção entre cálcio e magnésio.
O cálcio estabiliza a planta, mas o magnésio permite-lhe crescer.
Carências de magnésio são mais comuns do que se pensa, especialmente em águas desequilibradas ou purificadas.
Em aquários high-tech, garantir níveis adequados de Mg é essencial para manter folhas verdes e fotossíntese eficiente.

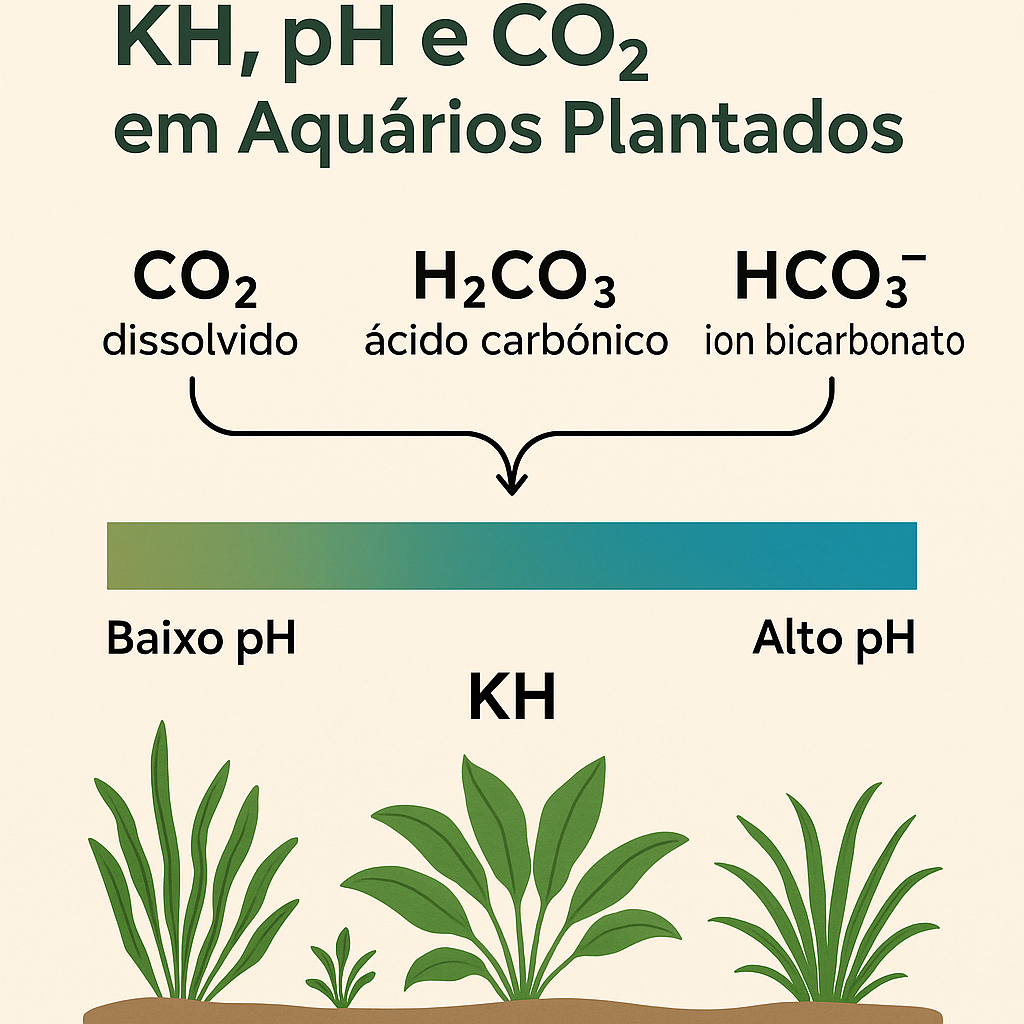
Num aquário plantado, o dióxido de carbono (CO₂) é um dos nutrientes mais importantes para o crescimento saudável das plantas. Mas o que muitos aquariofilistas não sabem ou não entendem é que o KH (dureza carbonatada) e o pH afetam diretamente a forma química em que esse carbono está disponível, e por consequência, o quanto dele as plantas conseguem realmente absorver.
Quando injetamos CO₂ na água, ele não permanece apenas como CO₂ dissolvido. Ele entra numa série de reações químicas que formam outras moléculas, num equilíbrio sensível ao pH:
CO₂ dissolvido (CO₂(aq))
Ácido carbónico (H₂CO₃)
Ião bicarbonato (HCO₃⁻)
Ião carbonato (CO₃²⁻)
Estas espécies químicas coexistem na água, mas a proporção entre elas muda radicalmente com o pH e KH. Eis como funciona:
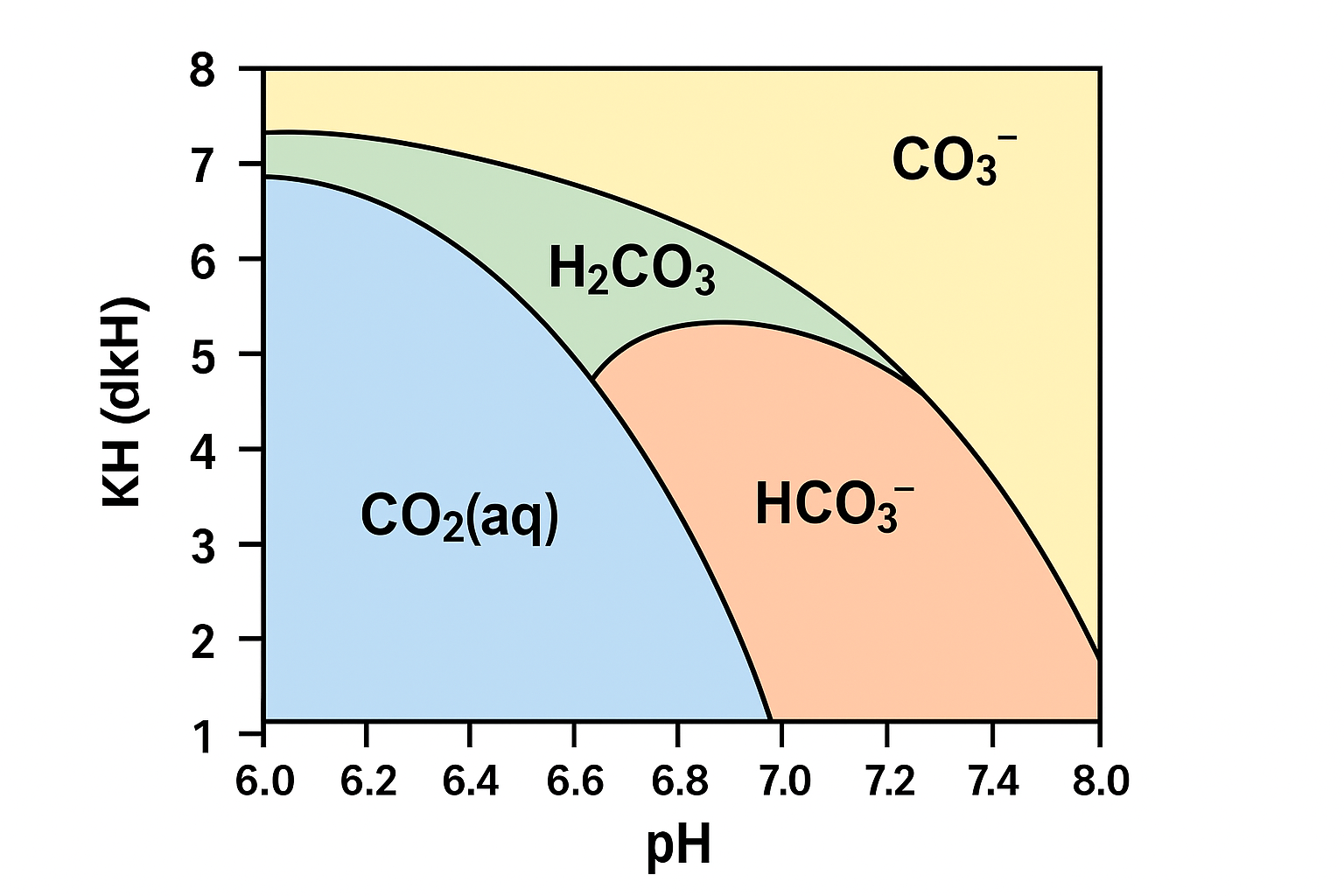
Predominância de CO₂ dissolvido e ácido carbónico (H₂CO₃)
Nesta zona do gráfico de equilíbrio, o carbono está principalmente em formas facilmente assimiláveis pelas plantas.
O CO₂ dissolvido é absorvido diretamente pelos estomas das folhas, sendo a forma mais eficiente para a fotossíntese.
O ácido carbónico é uma forma instável que se dissocia facilmente em CO₂ e água, contribuindo para esta disponibilidade.
Ideal para aquários plantados com injeção de CO₂, mas exige cuidado porque o pH pode flutuar mais facilmente, o que poderá não ser ideal para algumas especies, mas pela nossa experiencia e em especial tendo em conta que a grande maioria das especies de peixes e invertebrados usados em aquários plantados preferem originalmente águas mais ácidas, neste tipo de ambientes a flutuação de pH é algo normal e consequencia de águas moles com durezas baixas.
Equilíbrio dinâmico entre CO₂, H₂CO₃ e HCO₃⁻ (Ácido carbonico e bicarbonato)
Aqui começa a haver uma quantidade considerável de bicarbonato, mas ainda há CO₂ suficiente na forma dissolvida para as plantas.
Algumas plantas aquáticas conseguem utilizar também o HCO₃⁻, mas esse processo é menos eficiente e energeticamente mais exigente.
Esta faixa representa um bom compromisso entre estabilidade de pH e eficiência na absorção de CO₂.
Predomínio de bicarbonato (HCO₃⁻) e carbonato (CO₃²⁻)
O CO₂ dissolvido praticamente desaparece e o carbono passa a existir quase exclusivamente em formas menos disponíveis para as plantas.
Algumas espécies adaptadas conseguem aproveitar o bicarbonato, mas a maioria das plantas não.
O carbonato (CO₃²⁻), presente em pH ainda mais altos, é inútil para as plantas e pode até precipitar com cálcio e magnésio, reduzindo a dureza geral da água.
Nestes parâmetros, a injeção de CO₂ torna-se ineficiente ou até inútil, e o crescimento das plantas pode estagnar.
O KH atua como tampão, resistindo à queda de pH causada pela injeção de CO₂. No entanto, um KH alto torna mais difícil acidificar a água até níveis onde o CO₂ fique disponível em forma útil.
Resumidamente:
| KH | pH resultante | Forma predominante de carbono |
Disponibilidade para plantas |
|---|---|---|---|
| Baixo (1–3) | 6.0–6.6 | CO₂(aq), H₂CO₃ | Alta (ideal) |
| Médio (4–6) | 6.6–7.2 | CO₂ + HCO₃⁻ | Moderada |
| Alto (7+) | >7.4 | HCO₃⁻, CO₃²⁻ | Baixa |
Manter o KH entre 3 e 5 dKH permite que o CO₂ esteja maioritariamente disponível nas formas preferidas pelas plantas, sem comprometer a estabilidade do sistema. Este equilíbrio delicado entre ácidos e bases é a base da saúde de um aquário plantado.
Na Soluções Aquáticas, temos produtos específicos para te ajudar a ajustar o KH e a manter os parâmetros ideais para cada tipo de montagem. Se precisares de ajuda a interpretar os teus valores de pH, KH e CO₂, fala connosco. Garantimos que nenhuma planta vai passar fome de carbono!
Agora vamos exclarecer algumas questões ou detalhes que certamente alguns de vós poderão ter.
Quando o dióxido de carbono (CO₂) é injetado no aquário, ele não permanece apenas “a flutuar” na água. Em contacto com as moléculas de H₂O, o CO₂ inicia uma reação reversível fundamental para a química da água:
O CO₂ entra na água sob pressão (geralmente por difusores) e uma parte dele fica como CO₂(aq), ou seja, CO₂ fisicamente dissolvido na água.
Esta é a forma mais eficiente para a fotossíntese das plantas.
As plantas absorvem o CO₂ diretamente da coluna de água para realizar a fotossíntese.
Mas nem todo o CO₂ permanece nesta forma. Uma parte reage com a água, formando ácido carbónico:
O ácido carbónico é um ácido fraco e instável. Ele não existe em grande concentração na água, mas é extremamente importante porque:
Funciona como ponte entre o CO₂ e as outras formas de carbono (como o bicarbonato e o carbonato).
Dá início à cadeia de reações ácido-base que regulam o pH da água.
Quando o CO₂ forma ácido carbónico, ele acidifica ligeiramente a água. Isso acontece porque o H₂CO₃ pode dissociar-se em:
Essa libertação de H⁺ (protões) é o que baixa o pH da água.
Mas atenção: o quanto o pH vai baixar depende da presença do KH (bicarbonato), que age como tampão, resistindo à acidez.
CO₂ entra na água → forma CO₂(aq)
CO₂(aq) + H₂O → forma ácido carbónico (H₂CO₃)
H₂CO₃ → liberta H⁺ → pH baixa
Bicarbonato presente (KH) neutraliza parte da acidez
Em águas com KH muito alto, pouco CO₂ se transforma em H₂CO₃, e menos ainda em CO₂ disponível para as plantas.
Em águas com KH muito baixo, a formação de H₂CO₃ é eficaz, mas o pH pode oscilar perigosamente.
O segredo é manter o KH entre 3 e 5 dKH, permitindo que parte do CO₂ se converta em ácido carbónico, sem desestabilizar o sistema.

Na água do aquário, o ácido carbónico (H₂CO₃) está em equilíbrio com os seus produtos de dissociação:
Este equilíbrio é extremamente dinâmico e está sempre a ajustar-se consoante o pH, o KH e a presença de CO₂ dissolvido. Vamos focar-nos num ponto muito importante:
O H₂CO₃ dissocia-se em H⁺ (íon de hidrogénio) e HCO₃⁻ (bicarbonato).
À primeira vista, parece lógico pensar:
"Se o ácido carbónico liberta H⁺, então o pH vai baixar, certo?"
Sim... mas não exatamente. Eis o porquê:
O ião HCO₃⁻ é uma base fraca — ou seja, tem capacidade para aceitar H⁺.
A sua presença neutraliza parcialmente o efeito acidificante do H⁺ que foi libertado.
Em termos simples: o bicarbonato é mais alcalino do que o H⁺ é ácido, pelo que o pH não desce tanto quanto seria de esperar.
Isto é exatamente o que dá ao KH o seu poder tampão: a capacidade de resistir a variações de pH ao absorver ou ceder iões H⁺ conforme necessário.
Quando adicionamos CO₂ à água, mais ácido carbónico se forma, e parte dele dissocia-se, libertando H⁺.
O pH tende a descer, mas o KH vai resistindo a essa descida — porque o bicarbonato neutraliza parte do H⁺.
Se o KH for muito baixo, esta neutralização é fraca e o pH pode cair rapidamente.
Se o KH for alto, o pH mantém-se estável — mas o CO₂ disponível em formas úteis (CO₂(aq) e H₂CO₃) será muito menor.
O bicarbonato (HCO₃⁻) age como um "almofadador" do pH.
A libertação de H⁺ pelo ácido carbónico não provoca uma grande queda no pH porque o bicarbonato compensa essa acidez.
É por isso que o pH do aquário não muda bruscamente com a adição de CO₂... até que o KH esteja quase esgotado.
Depois da formação de ácido carbónico (H₂CO₃) e da sua dissociação em bicarbonato (HCO₃⁻), o equilíbrio pode avançar mais um passo — especialmente em águas com pH mais alto — formando:
O pH ultrapassa os 8.2
O KH (dureza carbonatada) está elevado
Há pouca concentração de CO₂ dissolvido na água (ou seja, pouco ácido carbónico para puxar o equilíbrio para trás)
É uma reação que marca a transição da água para um meio muito alcalino — e aqui começam os problemas para as plantas.
O carbonato (CO₃²⁻) é uma forma de carbono praticamente inútil para as plantas aquáticas.
A maioria das plantas não consegue absorver CO₃²⁻, e mesmo as que usam bicarbonato (como Vallisneria ou Egeria) não têm mecanismos para o carbonato.
Portanto, quanto mais o equilíbrio pende para o lado dos carbonatos, menos carbono disponível haverá para as plantas, mesmo que o KH esteja alto.
Este é um ponto fascinante:
Quando o bicarbonato se transforma em carbonato, liberta mais um H⁺ — o que deveria baixar o pH.
Mas isso não acontece visivelmente, porque o carbonato (CO₃²⁻) é uma base muito mais forte que o bicarbonato.
A alcalinidade da água aumenta ainda mais, e o sistema fica mais resistente a mudanças de pH.
Resultado: o pH estabiliza em valores altos, geralmente entre 8.2 e 8.5 ou até mais.
Esta reação ocorre em pH elevado
Carbonato não é absorvido pelas plantas
Reduz a disponibilidade de carbono útil
Aumenta a alcalinidade e a resistência do pH
Se o KH e o pH forem demasiado altos, o equilíbrio ácido-base move-se na direção errada — o carbono útil para as plantas (CO₂ e H₂CO₃) dá lugar a bicarbonato e depois a carbonato.
É por isso que manter o KH entre 3–5 dKH e o pH entre 6.5–7.2 é a melhor forma de garantir uma boa concentração de carbono disponível para as plantas aquáticas.
Se o objetivo principal do aquário for o crescimento saudável e exuberante das plantas, então o ideal é manter o KH o mais próximo possível de zero, ou no máximo até 3 dKH. Nessa faixa, a absorção de CO₂ pelas plantas é máxima, pois o carbono permanece predominantemente nas formas que elas realmente conseguem utilizar: CO₂ dissolvido e ácido carbónico.
Mesmo em Portugal, onde temos águas relativamente boas para a aquariofilia, a maioria dos aquariofilistas continua a utilizar água da rede, com durezas carbonatadas moderadas ou até elevadas. Isso limita drasticamente o potencial de um aquário plantado, especialmente quando se investe em fertilizantes, iluminação de topo, CO₂ pressurizado e hardscape de qualidade.
O curioso — e por vezes frustrante — é que muitos desses aquários não atingem o nível de excelência simplesmente por não se ter optado por uma solução tão básica como a utilização de água de osmose inversa (RO), remineralizada com precisão. Este pequeno passo pode ser o divisor de águas entre um bom aquário e um aquário de nível mundial.
Publicado por: Ivo Lança Soares 02/04/2025