Loja de Aquariofilia e de Aquascaping

Num aquário plantado, o dióxido de carbono (CO₂) é um dos nutrientes mais importantes para o crescimento saudável das plantas. Mas o que muitos aquariofilistas não sabem ou não entendem é que o KH (dureza carbonatada) e o pH afetam diretamente a forma química em que esse carbono está disponível, e por consequência, o quanto dele as plantas conseguem realmente absorver.
Quando injetamos CO₂ na água, ele não permanece apenas como CO₂ dissolvido. Ele entra numa série de reações químicas que formam outras moléculas, num equilíbrio sensível ao pH:
CO₂ dissolvido (CO₂(aq))
Ácido carbónico (H₂CO₃)
Ião bicarbonato (HCO₃⁻)
Ião carbonato (CO₃²⁻)
Estas espécies químicas coexistem na água, mas a proporção entre elas muda radicalmente com o pH e KH. Eis como funciona:
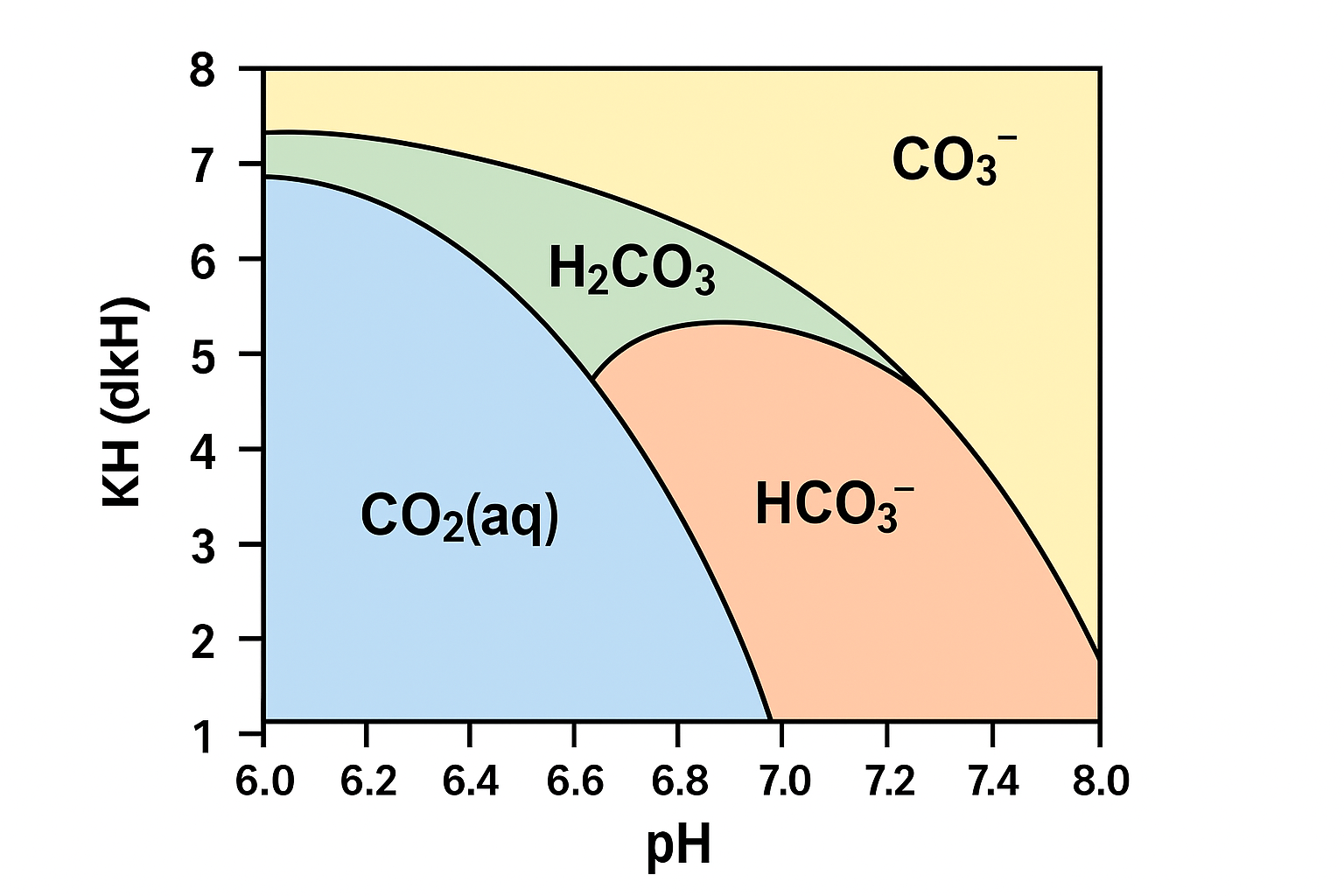
Predominância de CO₂ dissolvido e ácido carbónico (H₂CO₃)
Nesta zona do gráfico de equilíbrio, o carbono está principalmente em formas facilmente assimiláveis pelas plantas.
O CO₂ dissolvido é absorvido diretamente pelos estomas das folhas, sendo a forma mais eficiente para a fotossíntese.
O ácido carbónico é uma forma instável que se dissocia facilmente em CO₂ e água, contribuindo para esta disponibilidade.
Ideal para aquários plantados com injeção de CO₂, mas exige cuidado porque o pH pode flutuar mais facilmente, o que poderá não ser ideal para algumas especies, mas pela nossa experiencia e em especial tendo em conta que a grande maioria das especies de peixes e invertebrados usados em aquários plantados preferem originalmente águas mais ácidas, neste tipo de ambientes a flutuação de pH é algo normal e consequencia de águas moles com durezas baixas.
Equilíbrio dinâmico entre CO₂, H₂CO₃ e HCO₃⁻ (Ácido carbonico e bicarbonato)
Aqui começa a haver uma quantidade considerável de bicarbonato, mas ainda há CO₂ suficiente na forma dissolvida para as plantas.
Algumas plantas aquáticas conseguem utilizar também o HCO₃⁻, mas esse processo é menos eficiente e energeticamente mais exigente.
Esta faixa representa um bom compromisso entre estabilidade de pH e eficiência na absorção de CO₂.
Predomínio de bicarbonato (HCO₃⁻) e carbonato (CO₃²⁻)
O CO₂ dissolvido praticamente desaparece e o carbono passa a existir quase exclusivamente em formas menos disponíveis para as plantas.
Algumas espécies adaptadas conseguem aproveitar o bicarbonato, mas a maioria das plantas não.
O carbonato (CO₃²⁻), presente em pH ainda mais altos, é inútil para as plantas e pode até precipitar com cálcio e magnésio, reduzindo a dureza geral da água.
Nestes parâmetros, a injeção de CO₂ torna-se ineficiente ou até inútil, e o crescimento das plantas pode estagnar.
O KH atua como tampão, resistindo à queda de pH causada pela injeção de CO₂. No entanto, um KH alto torna mais difícil acidificar a água até níveis onde o CO₂ fique disponível em forma útil.
Resumidamente:
| KH | pH resultante | Forma predominante de carbono |
Disponibilidade para plantas |
|---|---|---|---|
| Baixo (1–3) | 6.0–6.6 | CO₂(aq), H₂CO₃ | Alta (ideal) |
| Médio (4–6) | 6.6–7.2 | CO₂ + HCO₃⁻ | Moderada |
| Alto (7+) | >7.4 | HCO₃⁻, CO₃²⁻ | Baixa |
Manter o KH entre 3 e 5 dKH permite que o CO₂ esteja maioritariamente disponível nas formas preferidas pelas plantas, sem comprometer a estabilidade do sistema. Este equilíbrio delicado entre ácidos e bases é a base da saúde de um aquário plantado.
Na Soluções Aquáticas, temos produtos específicos para te ajudar a ajustar o KH e a manter os parâmetros ideais para cada tipo de montagem. Se precisares de ajuda a interpretar os teus valores de pH, KH e CO₂, fala connosco. Garantimos que nenhuma planta vai passar fome de carbono!
Agora vamos exclarecer algumas questões ou detalhes que certamente alguns de vós poderão ter.
Quando o dióxido de carbono (CO₂) é injetado no aquário, ele não permanece apenas “a flutuar” na água. Em contacto com as moléculas de H₂O, o CO₂ inicia uma reação reversível fundamental para a química da água:
O CO₂ entra na água sob pressão (geralmente por difusores) e uma parte dele fica como CO₂(aq), ou seja, CO₂ fisicamente dissolvido na água.
Esta é a forma mais eficiente para a fotossíntese das plantas.
As plantas absorvem o CO₂ diretamente da coluna de água para realizar a fotossíntese.
Mas nem todo o CO₂ permanece nesta forma. Uma parte reage com a água, formando ácido carbónico:
O ácido carbónico é um ácido fraco e instável. Ele não existe em grande concentração na água, mas é extremamente importante porque:
Funciona como ponte entre o CO₂ e as outras formas de carbono (como o bicarbonato e o carbonato).
Dá início à cadeia de reações ácido-base que regulam o pH da água.
Quando o CO₂ forma ácido carbónico, ele acidifica ligeiramente a água. Isso acontece porque o H₂CO₃ pode dissociar-se em:
Essa libertação de H⁺ (protões) é o que baixa o pH da água.
Mas atenção: o quanto o pH vai baixar depende da presença do KH (bicarbonato), que age como tampão, resistindo à acidez.
CO₂ entra na água → forma CO₂(aq)
CO₂(aq) + H₂O → forma ácido carbónico (H₂CO₃)
H₂CO₃ → liberta H⁺ → pH baixa
Bicarbonato presente (KH) neutraliza parte da acidez
Em águas com KH muito alto, pouco CO₂ se transforma em H₂CO₃, e menos ainda em CO₂ disponível para as plantas.
Em águas com KH muito baixo, a formação de H₂CO₃ é eficaz, mas o pH pode oscilar perigosamente.
O segredo é manter o KH entre 3 e 5 dKH, permitindo que parte do CO₂ se converta em ácido carbónico, sem desestabilizar o sistema.

Na água do aquário, o ácido carbónico (H₂CO₃) está em equilíbrio com os seus produtos de dissociação:
Este equilíbrio é extremamente dinâmico e está sempre a ajustar-se consoante o pH, o KH e a presença de CO₂ dissolvido. Vamos focar-nos num ponto muito importante:
O H₂CO₃ dissocia-se em H⁺ (íon de hidrogénio) e HCO₃⁻ (bicarbonato).
À primeira vista, parece lógico pensar:
"Se o ácido carbónico liberta H⁺, então o pH vai baixar, certo?"
Sim... mas não exatamente. Eis o porquê:
O ião HCO₃⁻ é uma base fraca — ou seja, tem capacidade para aceitar H⁺.
A sua presença neutraliza parcialmente o efeito acidificante do H⁺ que foi libertado.
Em termos simples: o bicarbonato é mais alcalino do que o H⁺ é ácido, pelo que o pH não desce tanto quanto seria de esperar.
Isto é exatamente o que dá ao KH o seu poder tampão: a capacidade de resistir a variações de pH ao absorver ou ceder iões H⁺ conforme necessário.
Quando adicionamos CO₂ à água, mais ácido carbónico se forma, e parte dele dissocia-se, libertando H⁺.
O pH tende a descer, mas o KH vai resistindo a essa descida — porque o bicarbonato neutraliza parte do H⁺.
Se o KH for muito baixo, esta neutralização é fraca e o pH pode cair rapidamente.
Se o KH for alto, o pH mantém-se estável — mas o CO₂ disponível em formas úteis (CO₂(aq) e H₂CO₃) será muito menor.
O bicarbonato (HCO₃⁻) age como um "almofadador" do pH.
A libertação de H⁺ pelo ácido carbónico não provoca uma grande queda no pH porque o bicarbonato compensa essa acidez.
É por isso que o pH do aquário não muda bruscamente com a adição de CO₂... até que o KH esteja quase esgotado.
Depois da formação de ácido carbónico (H₂CO₃) e da sua dissociação em bicarbonato (HCO₃⁻), o equilíbrio pode avançar mais um passo — especialmente em águas com pH mais alto — formando:
O pH ultrapassa os 8.2
O KH (dureza carbonatada) está elevado
Há pouca concentração de CO₂ dissolvido na água (ou seja, pouco ácido carbónico para puxar o equilíbrio para trás)
É uma reação que marca a transição da água para um meio muito alcalino — e aqui começam os problemas para as plantas.
O carbonato (CO₃²⁻) é uma forma de carbono praticamente inútil para as plantas aquáticas.
A maioria das plantas não consegue absorver CO₃²⁻, e mesmo as que usam bicarbonato (como Vallisneria ou Egeria) não têm mecanismos para o carbonato.
Portanto, quanto mais o equilíbrio pende para o lado dos carbonatos, menos carbono disponível haverá para as plantas, mesmo que o KH esteja alto.
Este é um ponto fascinante:
Quando o bicarbonato se transforma em carbonato, liberta mais um H⁺ — o que deveria baixar o pH.
Mas isso não acontece visivelmente, porque o carbonato (CO₃²⁻) é uma base muito mais forte que o bicarbonato.
A alcalinidade da água aumenta ainda mais, e o sistema fica mais resistente a mudanças de pH.
Resultado: o pH estabiliza em valores altos, geralmente entre 8.2 e 8.5 ou até mais.
Esta reação ocorre em pH elevado
Carbonato não é absorvido pelas plantas
Reduz a disponibilidade de carbono útil
Aumenta a alcalinidade e a resistência do pH
Se o KH e o pH forem demasiado altos, o equilíbrio ácido-base move-se na direção errada — o carbono útil para as plantas (CO₂ e H₂CO₃) dá lugar a bicarbonato e depois a carbonato.
É por isso que manter o KH entre 3–5 dKH e o pH entre 6.5–7.2 é a melhor forma de garantir uma boa concentração de carbono disponível para as plantas aquáticas.
Se o objetivo principal do aquário for o crescimento saudável e exuberante das plantas, então o ideal é manter o KH o mais próximo possível de zero, ou no máximo até 3 dKH. Nessa faixa, a absorção de CO₂ pelas plantas é máxima, pois o carbono permanece predominantemente nas formas que elas realmente conseguem utilizar: CO₂ dissolvido e ácido carbónico.
Mesmo em Portugal, onde temos águas relativamente boas para a aquariofilia, a maioria dos aquariofilistas continua a utilizar água da rede, com durezas carbonatadas moderadas ou até elevadas. Isso limita drasticamente o potencial de um aquário plantado, especialmente quando se investe em fertilizantes, iluminação de topo, CO₂ pressurizado e hardscape de qualidade.
O curioso — e por vezes frustrante — é que muitos desses aquários não atingem o nível de excelência simplesmente por não se ter optado por uma solução tão básica como a utilização de água de osmose inversa (RO), remineralizada com precisão. Este pequeno passo pode ser o divisor de águas entre um bom aquário e um aquário de nível mundial.
Publicado por: Ivo Lança Soares 02/04/2025